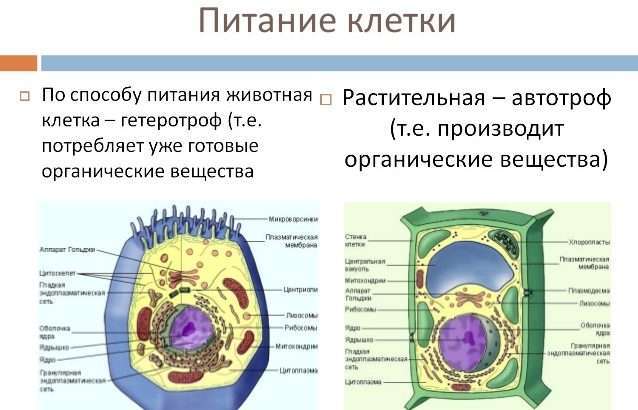
До сих пор мы видели, что миозиновый ствол служит просто связующим стержнем между двумя пучками актиновых филаментов — картина красивая, но статичная. Однако стоит нескольким ионам кальция достичь этой системы, как взору туриста, путешествующего по живой клетке, предстанет одно из самых поразительных проявлений молекулярной пиротехники: внезапно миозиновые головки оживают и начинают неистово сгибаться на своих ножках, где бы они ни прикреплялись к сайтам связывания на актиновом филаменте, подтягивая его на 10 нм внутрь в направлении середины ствола. После этого они ослабляют «хватку». Однако к тому моменту другие миозиновые головки приходят в соприкосновение с актиновыми сайтами связывания и осуществляют дальнейшее их подтягивание и перемещение на 10 нм. Это продолжается до тех пор, пока присутствуют ионы кальция (а также АТФ, см. ниже). Все актиновые филаменты на каждом конце миозинового стержня «подтягиваются» одинаково, тем самым давая возможность двум противоположно направленным пучкам актиновых филаментов, связанных миозиновым стержнем, скользить друг к- другу и притягивать соответствующие точки прикрепления ближе к середине, т. е. сближать их. При этом расстояние между соседними точками прикрепления сокращается, хотя ни один из филаментов, соединяющих эти точки, не укорачивается. Филаменты скользят относительно друг друга, используя своеобразный молекулярный «храповик».
В ходе этого процесса совершается механическая работа и поэтому требуется энергия, которая, что вряд ли вас удивит, поставляется за счет гидролиза АТФ в АДФ и Фн. Миозиновые головки в действительности представляют собой высокоспецифичные гидролизующие АТФ ферменты (АТФазы). Они могут проявлять свою каталитическую активность при трех условиях: 1) будучи связаны с актином; 2) будучи активированы ионами кальция (механизм активации мы рассмотрим позднее) и 3) имея возможность при этом сгибаться. Непременное сопряжение между химическими реакциями гидролиза АТФ и конформационным изменением, которое заставляет головку связанного с актином миозина сгибаться на ножке и продвигаться вдоль актинового филамента, — важнейшее, основополагающее свойство, позволяющее актинмиозиновой системе превращать свободную энергию гидролиза АТФ в механическую работу.Вид выполняемой работы зависит от расположения в клетке двух точек прикрепления, которые притягиваются друг к другу, и их топологических взаимоотношений. Нередко одна точка прикрепления остается фиксированной, а перемещается только другая точка. Рассмотрим, например, ползание клетки. Участок плазматической мембраны, к которому прикреплен пучок актиновых филаментов, плотно прикрепляется к субстрату (адгезивная пластинка); после прикрепления к субстрату актинмиозиновый комплекс укорачивается и тащит все, что к нему прикреплено, вплоть до целой клетки через ее цитоскелет по направлению к пластинке адгезии. Как только движение прекращается, адгезивная пластинка «отклеивается» и впереди появляются новые пластинки адгезии, образованные складчатыми выростами, ламеллоподиями , которые выпускают клейкие пальцевидные выросты — филоподии. По мнению некоторых исследорателей, описанное явление может лежать в основе механизма амебоидного движения, посредством которого клетки передвигаются по направлению (положительный хемотаксис) или от (отрицательный хемотаксис) определенных объектов, посылающих химические сигналы.
Как мы уже видели, актиновые волокна нередко располагаются непосредственно под плазматической мембраной в виде поясов или сплетений различной формы, иногда связанных с осевыми волокнами в сердцевине микроворсинок и других клеточных выростов. Уплотнение пояска вызывает сокращение клетки; сокращение сплетения приводит к сжатию клетки, сморщиванию или округлению ее поверхности, образованию складок, выступов или впячиваний или других деформаций поверхности клетки; натяжение или подтягивание осевых волокон вызывает наклон микроворсинки. И, если точки прикрепления фиксированы на внутриклеточных органеллах, можно видеть, как последние перемещаются друг относительно друга и относительно клеточной поверхности.
В самом деле, нетрудно представить, по крайней мере теоретически, как неисчислимое многообразие движений, производимых живыми клетками, может осуществляться координированной работой сотен крошечных миозиновых цитомышц, активно перемещающих актиновые цитокости в различных направлениях. Здесь можно провести аналогию со сложным человеческим организмом: ведь и сложные движения нашего собственного тела можно объяснить работой мышц по перемещению костей или образованию складок кожи. Но потребуется множество ультрамикроскопических исследовании и анализов, пока недоступных нашим современным техническим средствам, прежде чем ученые сумеют детально описать и объяснить в терминах перемещения детальную анатомию внутриклеточных костей и мышц. Эти трудности усугубляются и тем обстоятельством, что форма и взаимосвязи многих цитокостей изменяются, равно как и расположение сайтов для прикрепления многих цитомышц. Кроме того, как мы убедимся ниже, в клетках имеется вторая цитоскелетная система, образованная микротрубочками, и второй тип цитомышц, динеин, связанный с этой системой.
Сила, развиваемая актинмиозиновой системой, зависит от числа миозиновых головок, дружно работающих в данный конкретный момент, т. е. в тот отрезок времени, в течение которого филаменты взаимодействуют, и от числа параллельных филаментов, которые объединяются в этом усилии. Если мы рассмотрим единичную актин-миозиновую связь, то заметим, что каждый из шести актиновых филаментов, окружающих миозиновый стержень, имеет на своей свободной поверхности не занятые сайты для связывания с миозином. Исходя из этой особенности, можно предположить, что шесть филаментов первого пучка связывают дополнительные миозиновые стержни, которые в свою очередь могут окружить себя дополнительными филаментами и т. д. Повторяя такое расположение филаментов, мы придем к структуре с гексагональной симметрией, в которой каждый миозиновый филамент окружен шестью актиновыми филаментами, а каждый актиновый филамент — тремя миозиновыми стержнями, чередующимися с тремя актиновыми филаментами. Если в такой структуре обездвижить актиновые филаменты, склеив их актининовые корешки, и затем проскользнуть мимо вставленных миозиновых прутков, то в конце можно натолкнуться на «щетину» тонких актиновых филаментов, расположенных на расстоянии 15—25 нм друг от друга на каждом углу правильной гексагональной решетки, в которой каждый шестиугольник окружает отверстие, соответствующее толстому миозиновому филаменту. Это достигается с помощью соединительного белка, десмина, о котором мы упоминали выше. В мышечных клетках десмин образует также прямоугольную сеть, которая принимает гексагональную форму при погружении миозиновых стержней в актиновую щетину.
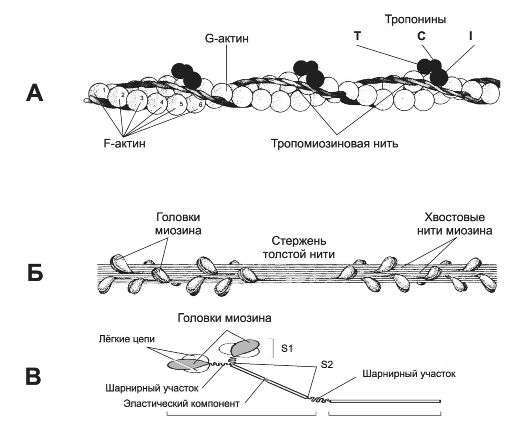
В поперечнополосатой мышце позвоночных все актиновые филаменты имеют одинаковую длину 1 мкм, а все миозиновые стержни—1,5 мкм. Целая единица из двух противоположно направленных актиновых «щетин», соединенных центральными миозиновыми стержнями, называется «саркомером» . Длина саркомера варьирует приблизительно от 3,5 мкм (актиновые филаменты почти полностью выдвинуты из миозиновых филаментов) до 1,5 мкм (оба вида филаментов полностью перекрывают друг друга). В последнем состоянии свободные концы актиновых’ филаментов (250 нм) соединяются в пучки в пространствах между гладкими серединами миозиновых стержней, тогда как конусообразные концы миозиновых стержней касаются а-актинин-десминовой сети, из которой берут начало актиновые филаменты. Было бы замечательно, если бы мы могли свободно побродить по саркомеру! Ведь, насколько можно судить, его устройству может позавидовать самый искусный садовник! Представьте себе ветвистые, украшенные гирляндами цветов миозиновые стволы, чередующиеся с тонкими актиновыми стеблями, изящно украшенными тропомиозином, расположенным в спиральных желобках, и тропонином. К сожалению, подобное путешествие потребовало бы от нас дальнейшего уменьшения по крайней мере во сто крат. Даже при нашем увеличении в миллион раз деревья этого молекулярного «леса» отстоят друг от друга на расстоянии меньше 2,5 см. К тому же это пространство почти целиком заполнено растущими на деревьях «цветами». В довершение всего нам грозила бы постоянная опасность «проскальзывания» ионов кальция и «захлопывания леса». Мы вынуждены довольствоваться двумерным пространственным изображением, полученным при помощи электронного микроскопа. Но даже уменьшенный до такой степени, молекулярный «лес» завораживает нас своей красотой.
В мышечной фибрилле значительное число саркомеров связано в группы десмином, который не только соединяет места прикрепления актина с образованием соответствующим образом расположенной «щетины», но также, как упоминалось ранее, склеивает две такие щетины «спина к спине». Именно регулярное чередование различных зон придает фибрилле ее характерную поперечную полосатость (исчерченность). Такие фибриллы могут достигать огромных размеров по масштабам клеточной шкалы. Они образуются из сотен клеток, которые, сливаясь, образуют синцитии . Фибриллы окружены сложной системой мембран, служащих главным образом для быстрого высвобождения и возвращения ионов каль-ция, посредством чего регулируется мышечное сокращение, и рядами митохондрий, обеспечивающих их энергией в виде АТФ.
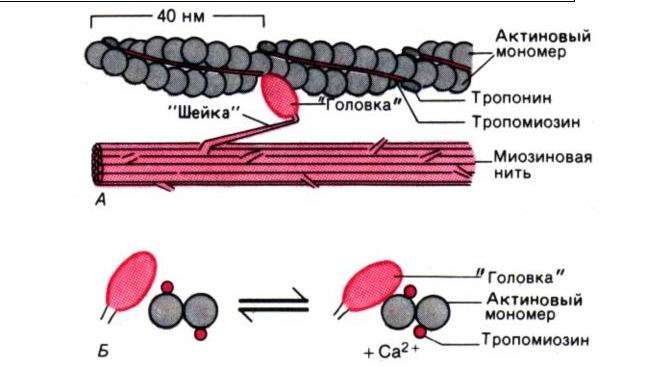
Фибрилла может находиться в трех состояниях. В отсутствие АТФ и кальция актин и миозин жестко сцеплены. Это состояние наблюдается при трупном окоченении, наступающем после смерти организма, когда прекращается производство АТФ. Стоит добавить АТФ, и структура становится податливой, пластичной. На головке миозина имеется связывающий АТФ сайт; когда он занят, головка не может взаимодействовать с актином (в отсутствие кальция, см. ниже), и филаменты беспрепятственно скользят друг относительно друга. Такие волокна почти не сопротивляются пассивному растяжению до тех пор, пока другие структурные элементы не вмешаются, чтобы предотвратить полное расхождение составляющих их филаментов. Это состояние свойственно разгибательной мышце при сокращении соответствующей сгибательной мышцы. Третье состояние фибрилла испытывает благодаря ио^ам^кальция, которые действуют через молекулы тропонина, прикрепленные к актиновым филаментам Тропонин состоит из трех субъединиц. Одна субъединица связывается с актином и называется И, так как ингибирует прикрепление миозина. Вторая субъединица, названная Т, связывается с тропомиозином. Эти две субъединицы соединены третьей, С, связывающей ионы кальция. С-субъединица служит пусковым механизмом (триггером) мышечного сокращения. В отсутствие кальция ее положение таково, что нити тропомиозина находятся вне желобков в актиновых филаментах и покрывают миозинсвязывающие сайты (оГГпозиция). Под влиянием ионов кальция С-субъединицы тропонина изменяются таким образом, что тропомиозин перемещается по направлению к желобкам актинового филамента (оппозиция). Это позволяет миозину взаимодействовать с актином, который одновременно активирует гидролиз АТФ и связанное конформационное изменение, которое мы наблюдали в одном актинмиозиновом пучке. Отметим, что в фибрилле каждый актиновый филамент тянут три миозиновых, согласованно действующих филамента. Однако не все миозиновые головки действуют одновременно; они активно помогают передвижению только тогда, когда «стратегически» располагаются относительно сайтов связывания на актине. Так обеспечивается очень плавное скольжение и укорочение. Если укорочение встречает сопротивление, развивается напряжение. Это состояние сохраняется до тех пор, пока С-субъединица тропонина занята кальцием и имеется достаточное количество АТФ для покрытия энергетических затрат.
Тропонин обнаружен только в поперечнополосатой мышце. В других мышечных и немышечных клетках сокращение обеспечивается иными средствами. Но основные принципы, по-видимому, универсальны. Насколько известно, актиновые филаменты противоположной полярности всегда устроены так, что обладают способностью скользить по направлению друг к другу, используя для этого своеобразный механизм типа «храповика», обеспечиваемый энергией за счет расщепляющих АТФ головок миозинподобных молекул.
Прежде чем продолжить наше путешествие, остановимся, чтобы в последний раз взглянуть на актиновую молекулу,эту, бесспорно, одну из удивительнейших конструкций из атомов, которую мы имели возможность подробно рассмотреть. Это не гигантская молекула. Она имеет молекулярную массу 42 ООО дальтон и образована 374 аминокислотами. Вместе с тем пространственное расположение этой -цепочки таково, что образуется не менее восьми специфических идеально расположенных сайтов связывания: четыре сайта для взаимодействия актиновых молекул между собой с образованием двухспирального И-актина; один сайт для АТФ/АДФ, вовлеченных в процесс полимеризации; один-два сайта для тропомиозина; один сайт для И-субъединицы тропонина и один, особенно важный сайт для прикрепления и одновременной активации расщепляющей АТФ головки миозина. Кроме того, более слабые сайты связывания позволяют актиновым волокнам соединяться поперечно, образуя правильно структурированные пучки, или стержни. Как появилась такая необычная конструкция, пока неизвестно. Но, возникнув, она практически не изменилась в ходе эволюции: в структуре актина, от амебы до кролика, практически не произошло никаких изменений.