В 1838 г. голландский химик Герардус Иоганнес Мульдер, один из пионеров в области анализа альбуминоидов (лат. а1- Ьиз — белый, а1Ьитеп — белок яйца), употребил термин «протеин» (греч. рго1еюз — основной, первичный) применительно к веществу, которое он считал основной составной частью коагулирующих при высокой температуре азотных соединений, таких, как фибрин крови, казеин молока и альбумин яйца (как раз к тому времени эти соединения начали относить к одному общему классу). Сам термин «протеин» был предложен Мульдеру шведским ученым Йёнсом Якобом Берцелиусом, одним из основоположников химии и «отцом» теории катализа.
Если вспомнить, когда все это происходило, то не приходится удивляться тому, что и Мульдер, и Берцелиус многое понимали чрезмерно упрощенно, тем не менее предложенная ими терминология окaзалась пророческой. Как выяснилось позднее, протеины не только первичные агенты всех процессов жизнедеятельности, — они, подобно своему тезке Протею, древнегреческому морскому божеству, обладают способностью принимать бесчисленные, самые разнообразные формы1.
Мы в этом легко убедимся, настроив наши «молекулярные очки» до высокой разрешающей способности, позволяющей детально рассмотреть предметы величиной всего в несколько нанометров. Даже при увеличении в миллион раз такие объекты все еще будут выглядеть не больше комара. Однако если рассмотреть под соответствующим увеличительным стеклом структуру комаров и других существ, равных им по размеру, то нашему взору откроется множество разнообразнейших форм и структур. Ту же картину можно наблюдать, изучая белки при дальнейшем увеличении. Разница лишь в том, что их формы более абстрактны и своими изящными изгибами скорее напоминают биоморфные скульптуры Ганса Арпа, нежели суставные угловатости (изгибы) насекомых. Одни белки имеют глобулярную, почти сферическую форму, другие, менее правильной формы, изогнуты, извиты или покрыты бугорками, третьи вытягиваются в тонкие нити, нередко спирально закрученные. Форма белков изменчива: они набухают, пульсируют, удлиняются, сокращаются или раскручиваются, иногда с ошеломляющей внезапностью.Большая часть белков находится внутри клетки, где основная их функция связана с катализом. Если бы шведский химик Берцелиус мог узнать об этом, он, несомненно, пришел бы в восторг, ибо именно он ввел этот термин для обозначения свойства некоторых веществ (получивших название катализаторов) облегчить протекание реакций, непосредственно не принимая в них участия. Известно, что существуют неорганические катализаторы, они применяются в химической промышленности, но в живой клетке обнаружены настоящие фокусники-катализаторы. Жизнь, даже если это жизнь ничтожного микроба, возможна только при наличии многих тысяч химических реакций; большинство из них в искусственных условиях воспроизвести невозможно, а если это и удается, то только при определенных условиях — высоком давлении и температуре или кислой среде, — которые несовместимы с жизнью. В живых клетках, однако, эти реакции осуществляются необычайно просто и быстро благодаря участию специфических катализаторов, называемых энзимами. Это слово, которое образовано от греческого гуте (дрожжи, закваска), напоминает нам о той исторической роли, которую сыграли исследования процесса алкогольной ферментации в описании первых внутриклеточных катализаторов (см. гл. 7). Был также принят термин «фермент», который сейчас оставлен2.
Практически каждая химическая реакция, происходящая в живом организме, протекает при участии специфического фермента, действие которого, как мы увидим во второй части нашего путешествия, часто дополняется одним или несколькими кофакторами, или коферментами. Все известные нам ферменты являются белками, следовательно, число различных вариантов белков значительно — по меньшей мере, несколько тысяч в каждой клетке; они обычно составляют около 20 % от ее веса, т.е. половину сухого веса (клетки). Помимо выполнения своей функции катализаторов белки принимают участие в таких процессах, как регуляция, транспортировка, передвижение и многие другие, а также играют важную, роль, будучи компонентами внутриклеточных и внеклеточных структур. Иными словами, белки действительно являются основной составной частью живой клетки.
Под воздействием высокой температуры или других физических или химических агентов белки легко теряют не только свою уникальную форму, но и свою каталити чешскую силу. Этот процесс называется денатурацией. Долгое время процесс денатурации считался необратимым, и это положение выдвигалось в качестве аргумента, доказывающего, что процесс сборки живых структур должен управляться особой силой или особым принципом. Сейчас эта точка зрения устарела; доказано, что в ряде случаев денатурация обратима.
В форме, присущей молекуле белка, нет ничего исключительного, она представляет собой не что иное, как наиболее вероятную конфигурацию, которую молекула примет в соответствующих условиях.
Весьма поучительно через наши «молекулярные очки» взглянуть на смесь денатурированных белковых молекул — все они выглядят одинаково и различаются только размерами. Вместо множества замысловатых, интересных и своеобразных форм и структур перед нами окажется клубок спутанных, длинных, чрезвычайно тонких нитей. Теперь, полагаю, нам легче понять, почему денатурация часто выступает как необратимое явление: отдельная нить не в состоянии выпутаться из общего клубка и принять характерную для нее форму, если для этого не будут созданы особые условия. Что еще важнее, благодаря денатурации мы получаем возможность увидеть в структуре молекулы белка нечто такое, что в противном случае могло бы ускользнуть от нашего внимания. Все белки являются нитевидными молекулами. Бесчисленное множество форм, которое мы наблюдаем, обусловлено спиралями и изгибами нитевидно расположенных атомов.
Как мы знаем из химии, общей структурой, объединяющей все эти различные формы, является остов (цепь), который образован из простой шестиатомной повторяющейся единицы, встречающейся до нескольких сотен раз:
Центральный атом углерода каждой единицы в структурной цепи имеет одну свободную валентность. Она может соединиться с одной из двадцати различных химических групп, ответственных за специфические свойства, которые отличают одни молекулы белка от других. Связь между единицами называется пептидной. Этот термин напоминает нам о том, что эта связь гидролизуется пищеварительным ферментом — пепсином, компонентом желудочного сока :
В результате расщепления всех этих связей в данной цепи образуются вещества следующей структуры:
Эти вещества называются аминокислотами, так как содержат аминогруппу (—nН2) и карбоксильную группу (—СООН). Более точное их название а-аминокислоты, поскольку обе группы присоединяются к а-углероду. Еще более точным обозначением является термин Ь-а-аминокислоты, ибо все они (за исключением оптически не-активного глицина) имеют конфигурацию типа Ь вокруг асимметричного а-углерода. Их стереоизомеры, 13-аминокислоты, встречаются в некоторых компонентах бактерий, включая антибиотики, но не в белках.
В образовании белков участвуют 20 различных аминокислот. Их структуры соответствуют (за исключением одного варианта, пролина) приведенной выше формуле и различаются только составом боковой-группы, К. Названия аминокислот,
их сокращения и условные обозначения приведены в табл. 1. Позже мы узнаем, что некоторые из этих условных обозначений используются также для обозначения нуклеозидов — другой важной группы веществ. В соответствующем контексте смешать их трудно. Там, где такая опасность все-таки существует, принято использовать сокращения из трех букв.
Аминокислоты, связанные между собой пептидной связью, называются остатками, а возникающие цепи — пептидами. Зачастую термину «пептид» предшествует греческий префикс, обозначающий число остатков аминокислот в цепи: например, ди; три; тетра; пента; олиго (мало); поли (много).
В целом пептидные цепи соответствуют общей структуре:
Они имеют свободную концевую аминогруппу (N-терминальную слева), свободную концевую карбоксильную группу (С-терминальную справа) и n— 1 пептидных связей.
Пептиды различаются числом (п), природой, порядком или последовательностью своих аминокислотных остатков. Их можно «сравнить со словами разной длины, в написании которых использован алфавит, состоящий из двадцати букв. Это особенно наглядно видно, если в записи использованы однобуквенные символы.
Пептиды представляют собой подвижные структуры благодаря присущей им способности вращаться вокруг N—С- и С—С- осей. Вращения вокруг самой пептидной связи не происходит. В результате пептиды приобретают более или менее извитую форму в зависимости от того, притягиваются или отталкиваются отдельные их части, а также от способности этих частей связывать или выделять молекулы воды. Кроме того, извилистость (складчатость) пептидной цепи часто зависит от наличия веществ, с которыми она способна соединяться. Многие подобные взаимодействия имеют физическую природу и не вызывают образования истинных химических (ковалентных) связей. Характер этих взаимодействий зависит от двух сил, которые часто называют именами открывших их исследователей: французского физика Кулона и голландского физика Ван-дер-Ваальса.
Силы Кулона — это электростатические силы. Под их воздействием происходит притяжение электрических зарядов с противоположными знаками и отталкивание электрических зарядов с одинаковыми знаками. В состав некоторых аминокислот входят К-группы, которые заряжены либо положительно, либо отрицательно при физиологических условиях. Другие аминокислоты, не будучи заряженными, поляризованы, иными словами, в них наблюдается локальное перемещение зарядов, создающее положительный и отрицательный полюсы. Все эти группы могут взаимодействовать электростатически.
Полярные, содержащие атом водорода, группы могут электростатически соединяться с отрицательными или отрицательно поляризованными группами посредством особой водородной связи, при которой атом водорода принадлежит обеим группам. Ниже представлен один из таких видов связи, играющий очень важную роль Эта связь (пунктирная линия) может соединять два пептида. Поэтому она играет важную роль в конформации белков и соответственно во всех структурных, каталитических и других функциональных свойствах, зависящих от этой конформации. Несколько позже, в ходе нашего путешествия мы увидим, что феномен попарного соединения оснований в нуклеиновых кислотах, определяющий передачу всей генетической информации в живом мире, зависит от такой же связи и от другой, сходной водородной связи:Ван-дер-ваальсовы силы ответственны за притяжение, существующее между неполярными группами, состоящими только из углерода и водорода, такими, как в углеводородах, входящих в состав бензина и других нефтепродуктов. В ряде аминокислот встречаются К-группы, способные устанавливать связи посредством ван-дер-ваальсовых сил.
Ключевым моментом при всех этих взаимодействиях является асимметричность молекулы воды, благодаря которой она становится полязированной:Таким образом, молекула воды способна соединиться электростатически со всеми электрически заряженными или поляризованными группами, которые по этой причине получили название гидрофильных. В отличие 6т этих групп неполярные группы не имеют сродства к воде; они гидрофобны, т. е. отталкивают воду. Это явление всем нам хорошо знакомо: так, масло с водой не смешивается, поверхности некоторых пластиков не промокают — они гидрофобные. Правда, термин «гидрофобный» в какой-то мере может ввести в заблуждение. Строго говоря, гидрофобные группы воду не отталкивают; они отталкиваются водой в результате сильной гидрофильности самих молекул воды, тесно соединенных друг с другом водородными связями.
Поскольку клеточная среда в значительной степени содержит воду, взаимодействия с водой оказывают большое влияние на конформационные изменения полипептидной цепи. Упрощенно картина выглядит так: полипептидная цепь принимает форму, при которой наибольшее число гидрофильных групп оказывается на ее по-верхности или в щелях, доступных воздействию воды, тогда как гидрофобные группы размещаются во внутренних, недоступных для воды участках, где они имеют возможность взаимодействовать между собой. Белки, в которых возможна сегрегация групп на основе аффинитета к воде, обычно растворимы в ней, в то время как белки, не способные окружить себя гидрофильной оболочкой, размещаются в гидрофобных областях, где их гидрофобные участки попадают под влияние сил, действующих по типу ван-дерваальсовых. Как мы вскоре увидим, такими структурами в основном являются мембраны.
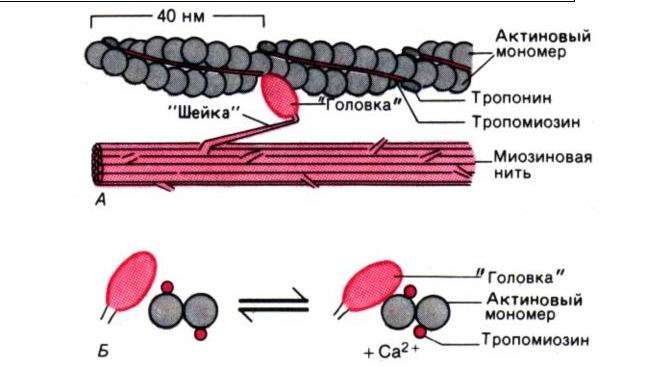
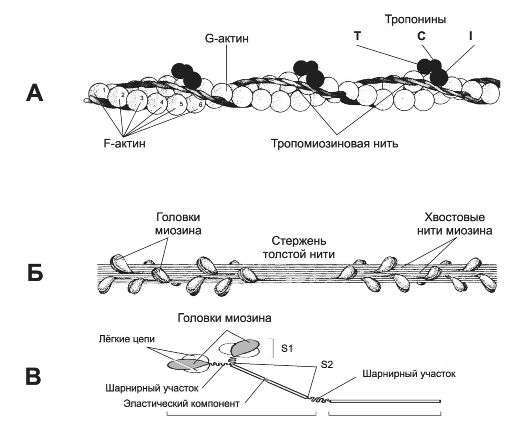
Важным фактором, определяющим конформацию белков, является тенденция по-липептидных цепей скручиваться в спиралевидную структуру, стабилизированную водородными связями между расположенными по соседству пептидными цепями. Наиболее часто встречается структура типа «-спирали с шагом (между витками) 0,54 нм, содержащая 3,6 остатков в одном витке. а-Спираль образует относительно неподвижный стержень толщиной примерно 1 нм с узловатой поверхностью, образованной К-группами остатков. Некоторые аминокислоты не могут приспособиться к этой структуре и разрывают ее. Поэтому а-спиральные участки обычно относительно коротки. Целые молекулы белка обычно содержат несколько таких стержней, соединенных (обычно под углом) группами менее упорядоченной конфигурации. В исключительных случаях последовательность полипептида такова, что позволяет поддерживать расположение а-спирали на значительном протяжении. Подобные молекулы по своей природе нитевидные. Кроме а-спирали возможны и другие расположения пептидов; иногда две или три полипептидные цепи закручиваются вместе (это так называемые суперскрученные спирали) и придают структуре нитевидную форму. Функция таких волокнистых белков в основном связана со структурной функцией и передвижением.
Помимо указанных внутренних факторов форма, принимаемая полипептидной цепью, зависит также от взаимодействия между самой цепью и другими молекулами белковой или небелковой природы. Многие наиболее важные функции белков зависят именно от таких взаимодействий, подчас оказывающих решающее влияние на кон- формацию соответствующих молекул. Иногда данная структура скрепляется истинной ковалентной связью между двумя участками одной и той же полипептидной цепи или между двумя цепями. Наиболее типичной связью этого типа является дисульфидная связь —8—5—, которая возникает при окислении тиоловых (—5Н) групп из двух цистеиновых остатков:
Многие белки состоят из одной полипептидной цепи; другие содержат две или более отдельные цепи или субъединицы, связанные между собой нековалентными силами притяжения, а иногда ковалентными связями, такими, как дисульфидные мостики.