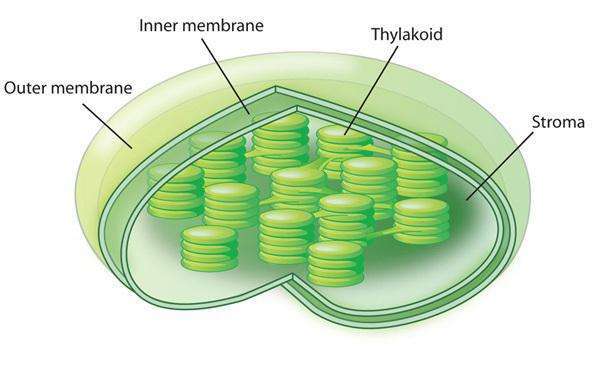
С химической точки зрения, гликолиз заключается в простом делении пополам молекулы глюкозы и перестройке ее атомов, которые не приводят ни к приобретению, ни к потере материи.Подсчитайте количество атомов с двух сторон стрелок, и вы обнаружите одинаковое количество атомов углерода, водорода и кислорода. С головы до хвоста «змея» не приобретает и не теряет массы. Однако между этими частями в теле «змеи» возникают довольно сложные и тонкие изменения; все они направлены на осуществление одной-единственной функции — получение АТФ. Это происходит на шестой и седьмой стадиях гликолиза в результате сложного процесса окислительно-восстановительнопо фосфорилирования.
Роль пяти стадий, предшествующих этой основной реакции, заключается в подготовке молекул глюкозы к участию в ней. Это весьма сложная и дорогостоящая работа, так как она связана с превращением 6-углеродной молекулы глюкозы в две молекулы фосфорилированного 3-угле — родного соединения, называемого фосфоглицериновым альдегидом. Две фосфатные группы, необходимые для этой цели, поступают от АТФ, так что мы сталкиваемся с поистине парадоксальной ситуацией: реакция, предназначенная для образования АТФ, начинается с ее потребления! И это не исключение. Многие питательные вещества прежде, чем стать пригодными для расщепления, требуют активизации, которая происходит с потреблением энергии. Это еще один из видов поденной работы, которая взвалена на молекулу АТФ, ответственную за все хозяйство клетки. Разумеется, начальный вклад энергии в последующем с лихвой оправдывается, иначе он был бы бессмысленным.
С образованием фосфоглицеринового альдегида мы подходим к главнейшей реакции гликолиза, которая заключается в окислении этого компонента в фосфоглицериновую кислоту и сопряженном с ним конденсировании АДФ и Фн в АТФ. Не станем останавливаться на всех деталях этой реакции, ибо это увлечет нас в дебри химии. Но один из аспектов заслуживает внимания: речь идет об истинном значении слова «окисление». Всем нам знакомо выражение, что мы получаем энергию, «сжигая» пищу. Но аналогия с каким-то типом двигателя внутреннего сгорания, которая при этом возникает в нашем сознании, является искажением реальности, а потому нуждается в исправлении. Строго говоря, превращение фосфоглицеринового альдегида в фосфоглицериновую кислоту происходит при добавлении одного атома кислорода к альдегидной группе (ОНО) с образованием карбоксильной группы кислоты (СООН). В этом смысле процесс напоминает тип окисления, сопровождающий сгорание. Однако при сгорании на воздухе из атмосферы поступает
дополнительный атом кислорода, чего нет в нашем случае. Гликолиз — это анаэробный процесс, который происходит при полном отсутствии кислорода. Здесь мы имеем дело со «сгоранием без доступа воздуха».
Но если не атмосферный кислород, то что же является источником дополнительного атома кислорода, приобретаемого фосфоглицериновым альдегидом? Ответ на наш вопрос — вода, хотя это не обычная вода из окружающей среды. Это молекула воды, которая получается из совместного конденсирования АДФ и Фн и поступает непосредственно в реакции окисления в химически связанной форме. Мы указываем на этот факт, заключив НгО в скобки; теперь, если обозначить оставшийся фосфоглицериновый радикал буквой К, уравнение реакции будет выглядеть следующим образом:
АДФ + Фн >- АТФ + (Н20),
К—СНО + (Н20) К—СООН —2Н.
Из уравнения видно, что смысл окислительной стадии заключается в удалении водорода. Это так называемая дегидрогенизация. Но здесь мы вновь должны проявить осторожность. Водород, образую-щийся в этой реакции, не является газообразным водородом Нг, стабильной двухатомной молекулой. Это реактивный атом водорода, Н, который никогда не встречается в свободной форме, но переносится или обменивается при посредничестве носителей в такой форме или в виде отдельного электрона (е~), с которым он свободно уравновешивается согласно взаимодействию
Н — _ е — + Н+
Протоны, или ионы водорода, Н+, участвующие в этом равновесии, всегда имеются в водной среде благодаря диссоциации воды:
Н20^ Н+ + ОН».
Таким образом, окислительную реакцию гликолиза можно записать и как удаление электронов:
К —СНО+ (Н20)~ К—СООН+ 2е~+ 2Н+.
То, что справедливо для гликолиза, справедливо и для большинства други хокислительных реакций в живых организмах. Как правило, реакции биологического окисления происходят без непосредственного участия кислорода, путем удаления атомов водорода или электронов. Такой тип реакций, по-видимому, унаследован с тех давних времен, когда впервые зародилась жизнь, и подвергался эволюции на протяжении сотен миллионов лет в отсутствие атмосферного кислорода. Когда окисляемая молекула приобретает кислород, как, например, в рассматриваемом случае, источником дополнительного кислорода служит вода или какие-либо реакции, при которых образуется вода.
Что касается атмосферного кислорода, который необходим для всех аэробных организмов, в том числе и для нас с вами, его роль заключается в том, чтобы собирать электроны, высвобождающиеся при окислительных реакциях:
‘ДО* + 2е~ + 2Н+-. Н20.
Конечный результат тот же, что и при обычном процессе сгорания, однако механизм иной. В этом легко убедиться с помощью тяжелого изотопа 1вО, который можно отличить от широко распространенного изотопа 1вО в масс-спектрографе. Если глюкоза сжигается в печи в присутствии |8С>2, изотоп будет выявляться в составе образующегося С02, что свидетельствует о соединении углерода глюкозы с атмосферным кислородом. Если же глюкоза сжигается в живом организме, дышащим |802, то образующийся изотоп мы найдем не в составе выдыхаемого СО2, а в НгО. Это, на первый взгляд, тривиальное различие составляет суть разницы, существующей между жизнью и смертью. Ни у одного организма не развился способ восстанавливать энергию в биологически пригодной форме из реакции окисления при сгорании. Напротив, имеются бесчисленные способы извлечения энергии посредством электронного переноса. Время от времени мы будем возвращаться к этому важному вопросу. Необходимо отметить, что в некоторых биологических реакциях действительно происходит добавление кислорода. Такие реакции, называемые реакциями оксигенации (в отличие от реакций окисления), не принимают . непосредственного участия в окислительном процессе восстановления энергии.Реакция, обратная окислению, — при-обретение атомов водорода или электронов — называется восстановлением. Так как электроны и атомы водорода не способны циркулировать в свободном виде в водной среде, оба вида реакций тесно связаны между собой. Электроны не могут высвобождаться, не будучи «пойманными»; если одно вещество окислилось, другое непременно должно восстановиться. Вот почему реакции всегда бывают окислительно-восстановительными (с переносок электронов). Ферменты, катализирующие такие переносы электронов, называются электронтрансферазами или оксидоредуктазами.
На основной окислительной стадии гликолиза акцептором электронов является НАД+, окисленная форма кофактора НАД, роль которого в этом и бесчисленном множестве других метаболических процессов определяется способностью выступать в качестве переносчика электронов:
НАД+ + 2е — + Н+ — НАДН.
Тогда полная реакция электронного переноса схематически запишется в следующем виде:
К—СНО + (Н20) 4 — НАД+ —
— К—СООН + НАДН + Н+.
Это и есть реакция, связанная с образованием АТФ (из которой, как вы, вероятно, помните, она получает свою скрытую ; молекулу воды). Каков бы ни был механизм этого сопряжения, он означает, что перенос одной пары электронов от фосфоглицеринового альдегида к НАД+, во-первых, высвобождает свободную энергию, достаточную для образования одной молекулы АТФ, и, во-вторых, подвергается ограничению, ибо этот процесс может происходить только при одновременном образовании АТФ.
Формально эту систему можно рассматривать как электрохимический преобразователь, который превращает поток электронов в химическую работу. Поэтому мы можем применить общую теорию электричества, которая гласит следующее: максимальное количество работы (реальная работа всегда меньше из-за неизбежных ‘ потерь тепла), которое может быть выполнено электрическим двигателем, определиется (в джоулях) количеством электричестм (в кулонах), проходящего через двигатель, умноженным на разность потенциалов /(в вольтах) электрического генератора.
В данном случае мы знаем количество работы. Она требует затраты 14 ккал (586 кДж) для образования 1 г-моль АТФ. Нем также известно количество электричества, проходящего через систему: % электрона на молекулу образующегося АТФ, или 2 электрон-эквивалента, или фарадея (2 X 96 500 == 193 кКл) на 1 г-моль АТФ. Если разделить джоули на кулоны, получится минимальное напряжение нашего электрического источника: 0,3 В или 300 мВ. Другими словами, перенос электронов между фосфоглицериновым альдегидом и НАД+ должен происходить при разности потенциалов как минимум 300 мВ, иначе он не сможет снабдить энергией синтез АТФ.
Конечно, гликолитическая «змея» построена далеко не так, как обычный электрический генератор. Она не имеет штепсельных розеток, в которые можно было бы вставить вольтметр и проверить наше заключение. Но в ней содержится донор электронов (фосфоглицериновый альдегид) и акцептор электронов (НАД+). Чтобы перенос электронов произошел, сродство к электронам у акцептора должно быть сильнее, чем у донора. . Это сродство можно измерить. Оно называется окислительно-восстановительным, или редокс — потенциалом, и выражается в вольтах. Каждая редокс-пара (восстановитель/окислитель, например, фосфоглицериновый альдегид/фосфоглицериновая кислота, НАДН/НАД+) обладает своим характерным редокс-потенциалом. Как мы уже установили в ходе предыдущих расчетов, при переносе пары электронов, необходимом для образования одной молекулы АТФ из АДФ и Фн, разность между окислительно-восстановительными потенциалами в парах донора и акцептора должна быть не меньше 300 мВ, что в действительности соответствует двум парам при гликолизе.
После того как главная задача, а именно образование АТФ, успешно решена, гликолитическая цепочка должна завершить свои дела и подвести итог проделанной работе. Это составляет основную функцию оставшейся части цепочки. Необходимо решить судьбу трех участников гликолиза: 1) фосфата, который первоначально был пожертвован цепи молекулой АТФ; 2) воды, которая поступила в цепь на окислительной стадии с тем, чтобы снабдить дополнительным кислородом фосфоглицериновую кислоту, и 3) электронов, которые покинули цепь на той же стадии. Эти дисбалансы теперь компенсируются. Во-первых, молекула воды отщепляется. Во-вторых, фосфатная группа возвращается к АДФ для восстановления АТФ, который был затрачен в самом начале процесса. И, в-третьих, НАДН возвращает свои электроны.
При молочно-кислом брожении акцептором является пировиноградная кислота, которая восстанавливается до молочной кислоты:
СНз—СО—СООН + НАДН + Н+ —
— СНз — СНОН—СООН + НАД+.
При спиртовом брожении акцептором является ацетальдегид — продукт декарбоксилирования пировиноградной кислоты, который восстанавливается до этилового спирта:
СНз—СО—СООН —СНз—СООН + С02,
СНз—СОН + НАДН + Н+ —
СНз—СН2ОН + НАД+
Последние электронные переносы происходят при очень малой разности потенциалов, без какой-либо энергетической выгоды. Они необходимы лишь для того, чтобы сделать систему автономной. Если отрезать хвост «змеи» и заменить его другим акцептором для сбора электронов,поступающих от НАДН, система будет; по-прежнему превосходно справляться со своей работой по производству АТФ, только теперь уже в качестве окислительной системы, и ее конечным продуктом будет пировиноградная кислота:
С6Н1206 — 2СН3—СО—СООН + 4е+ +4Н+
(глюкоза) (пировиноградная кислота)