Культуры клеток высших растений
Методики культивирования одиночных растительных клеток
Отдельные клеточки культивируют для получения клонов, исследования их генетической и физиологической изменчивости либо стабильности. Не считая того, культивирование отдельных клеток позволяет учить условия, определяющие появление стимулов к делению у клеток, изолированных от воздействия других клеток популяции либо ткани. Отдельные клеточки также важны для клоновой селекции мутантных, гибридных и трансформированных линий. Обычно в такие клеточки вводят маркерные гены, которые позволяют производить селекцию.
Не считая того, отдельные клеточки могут служить моделью для сравнительного исследования физиологических процессов в ткани и изолированной клеточке. К примеру, для исследования фотодыхания можно ассоциировать процесс фотосинтеза на уровне отдельных клеток мезофилла листа и целой ткани.
Выкармливание изолированных клеток складывается из 2-ух шагов: 1) изолирование неповрежденной клеточки растительной либо каллусной ткани; 2) создание критерий, подходящих для роста и развития изолированной клеточки.
На первом шаге нужно выделить неповрежденную и жизнестойкую клеточку из ткани целого растения либо каллусной ткани. Этого можно достигнуть методом обработки ткани пектиназами, что ведет к мацерации ее клеток. Но не всегда после таковой обработки клеточки сохраняют способность к следующим делениям и образованию ткани. Лучше получать отдельные клеточки из суспензионных культур либо рыхловатого каллуса. Безупречными отдельными клеточками являются протопласты, образовавшие клеточную стену.
Дальше клеточки изолируют или с помощью микроманипуляторов, или методом ряда поочередных разведений. При первых же попытках культивирования отдельных клеток появилась принципиальная научная неувязка: как вынудить делиться клеточки, изолированные от воздействия других клеток популяции либо тканей? Отдельные клеточки вели себя по другому, чем их скопления в виде агрегатов в суспензии либо каллусной массы на поверхности питательной среды.
При ее решении появилась догадка о «факторе кондиционирования». Так было названо вещество, стимулирующее деление отдельных клеток. Определено, что этот фактор имеет хим природу, термолабилен, водорастворим, низкомолекулярен (М. К. Павлова, Р. Г. Бутенко, 1965), видонеспецифичен, не подменяет известные фитогормоны, синергичен с брассиностероидами. Было предложено несколько вариантов культивирования отдельных клеток.
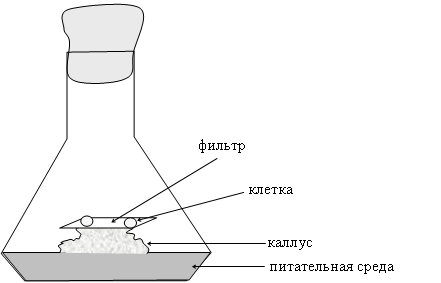
В первый раз подобрать условия, подходящие для деления отдельных клеток, удалось в 1954 году Мьюиру, Хильденбранту и Райкеру. Этот метод получил заглавие способа «ткани – няньки» (рис. 12).
Рис. 12. Схема использования каллуса в качестве «ткани — няньки»
Клеточку изолируют с помощью микроманипулятора из рыхловатого каллуса конкретно на кусок фильтра размером 8 * 8 мм, помещенный на вершину каллусной ткани, из которой была взята клеточка. Каллус должен находится в фазе активного роста. Можно также в качестве «няньки» использовать каллусную ткань другого растения схожего вида. В данном случае клеточки вырастают и делятся. По мере старения каллуса – няньки фильтр с клеточками переносится на юный каллус. Когда ткань из клеточки добивается размеров 0,5 – 1 мм, то ее можно высаживать конкретно на питательную среду.
Проводились также опыты по высаживанию клеточки конкретно на агаризованную среду, но непременно рядом с фильтром, который в течение нескольких дней контактировал с юный, активно возрастающей каллусной тканью. Так как эти работы проявили, что неизменный контакт клеточки через фильтр с каллусной массой не является неотклонимым для деления клеточки, то было предложено использовать старенькую культуральную среду для стимуляции одиночной клеточки к делению.
Можно также использовать способ «кормящего слоя». Для этого берут суспензию клеток такого же вида, что и одиночная клеточка, либо близкого вида. Клеточная суспензия должна находиться в ранешней экспоненциальной фазе ростового цикла. В 1959 году Бергман предложил фильтровать суспензионную культуру (в его опытах это были табак и фасоль) стерильно через один слой батиста (ячейки 0,3 * 0,1 мм). В итоге получали суспензию, на 90% состоящую из отдельных клеток. Эту суспензию соединяли с агаризованной питательной средой такого же состава, что употреблялся при культивировании суспензии (среда содержала 0,6% агара). Смесь разливали узким слоем (1 мм) в чашечки Петри. Агар делил клеточки, но не препятствовал обмену хим сигналами меж ними, а толщина слоя позволяла глядеть за их поведением под микроскопом.
Индукция делений отдельных клеток вероятна при применении очень богатой питательной среды, к примеру, среды Као и Михайлюка. При всем этом объем среды, в которую помещаются клеточки, был должен наименьшим (микрокапли объемом до 20 мкл).
Все эти методы культивирования позволяют клеточке «ощущать» фактор кондиционирования. Он или вырабатывается в достаточном количестве клеточками «кормящего слоя», «ткани – няньки», или содержится в суспензии, где ранее культивировались клеточки, или не пропадает в большенном объеме среды. Таким макаром, фактор, вызывающий деление клеток, вырабатывается самими клеточками, но в маленьком количестве. И только увеличивая число клеток, вырабатывающих этот фактор, чтоб он не рассеивался в огромных объемах питательной среды, либо же понижая объем среды, в каком будет выращиваться клеточка, можно вынудить ее делиться.
Читать далее ► культивирование гаплоидных клеток